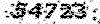آب تبلور
بیاو.....
ادامه
آب تبلور به چه معناست؟
آب تبلور آبی است که به همراه مولکولهای بعضی بلورهای جامدهای یونی است. هنگامی که یک جامد یونی از محلول آبی متبلور می شود به عنوان مثال باریم کلرید محلول در آب است و ما به وسیلهی تبخیر یک مقدار از محلول و اشباع کردن محلول، مقداری بلور BaCl2 به دست می آوریم. در این هنگام تعدادی از مولکولهای آب در شبکه بلور به دام افتاده و با بلور پیوندهای ضعیف واندروالسی برقرار می کند. در این هنگام ما به جای BaCl2 خالص، نمک متبلور آن را داریم و فرمول آن به صورت ((BaCl2, 2H2O(s) می باشد. به این گونه بلورهای نمکی که با مولکولهای آب همراه هستند، هیدرات و به آبی که این بلورها را همراهی می کند و در شبکه ی بلوری این نمکها وارد شده است، آب تبلور گفته می شود. مثال دیگر از این دست، سولفات مس هیدراته است که دارای 5 مولکول آب تبلور می باشد:( (CuSO4, 5H2O (s)
معمولا ً ظاهر هیدراتها با ترکیبات بی آب آنها کاملا ً تفاوت دارد. به طور معمول، هیدراتها بلورهای نسبتا ً بزرگ و غالبا ً شفاف تشکیل می دهند. هیدراتها بر اثر گرم شدن تجزیه می شوند و آب تبلور خود را به صورت بخار آب از دست می دهند.
BaCl2, 2H2O(s) à BaCl2 (s) + 2H2O(g(
از بین رفتن آب تبلور یک هیدرات را شکوفا شدن می نامند.
رنگ برخی از نمک های آب پوشیده با رنگ نمک بی آب آنها متفاوت است، از این رو، از این نمکها به عنوان شناساگر رطوبت استفاده می کنند. مثلا ً
قرمز رنگ CoCl2.2H2O
صورتی رنگ CoCl2.5H2O
بنفش رنگ CoCl2.4H2O
آبی رنگ CoCl2
مسائل مربوط متبلور معمولا ًَ به این صورت است که مقدار مشخصی از نمک را حرارت داده و وزن آن در اثر تبخیر آب درون آن کاسته می شود. از روی کاهش وزن داده شده از ما می خواهند که نسبت آب به نمک را محاسبه کنیم. به عنوان مثال:
023/1 گرم نمک آب پوشیده ی مس II سولفات را در یک بوته ی چینی حرارت می دهیم تا آب آن بخار شود. 654/0 گرم نمک بی آب مس II سولفات در بوته باقی می ماند. حساب کنید به ازای هر مول CuSO4، چند مول آب در نمک آبدار وجود داشته است.(جرم مولی مس، گوگرد، اکسیژن و هیدروژن به ترتیب 64، 32، 16 و 1 گرم بر مول است.)
برای حل این گونه سؤالات باید سه مرحله طی کنیم:
1- ابتدا این رابطه را بنویسیم و جرم هر یک از این گونه ها را حساب کنیم: آ- جرم نمک آبدار ب- جرم نمک بی آب ج- جرم آب و این رابطه را برایش بنویسیم:
جرم نمک آبدار = جرم نمک بی آب + جرم آب
2- تبدیل کردن جرم نمک بی آب به مول
3- تبدیل کردن جرم آب به مول
4- به دست آوردن نسبت مولی آب به نمک به وسیله ی تقسیم کردن مرحله ی 4 به مرحله ی 3
پس با استفاده از مرحله ی اول، ابتدا جرم آب بخار شده را حساب کنیم:
جرم آب بخار شده = جرم نمک آب پوشیده – جرم نمک بی آب
369/0 = 654/0 - 023/1
بنابراین مقدار آب بخار شده برابر 369/0 گرم می باشد.
2- حال باید تعداد مول نمک بی آب را محاسبه می نماییم. برای این منظور جرم نمک مورد نظر را در معکوس جرم مولی آن ضرب می نماییم.
= تعداد مول نمک بی آب
Mol 004/0=g CuSO4 160 / mol CuSO4 1 * g CuSO4 654/0
3- حال باید ببینیم این مقدار گرم آب برابر چند مول آب می باشد. برای این منظور به این ترتیب عمل می کنیم:یعنی باید جرم مورد نظر را در معکوس جرم مولی آب ضرب نماییم. جرم مولی نیز با جمع جرم اتمهای تشکیل دهنده ی با در نظر گرفتن تعداد آن ها به دست می آید.
= تعداد مول آب بخار شده
Mol 020/0=g H2O 0/18 / mol H2O 1 * g H2O 369/0
4- حال نسبت تعداد مول های آب بخار شده به مول های نمک بی آب را به وسیله ی تقسیم آن ها به یکدیگر به دست می آوریم.
1/5 = mol 400/0 / mol 020/0 = تعداد مول CuSO4 / تعداد مول H2O
پس نسبت آب به نمک برابر 5 به 1 است. بنابراین فرمول تجربی این نمک CuSO4.5H2O بوده، تعداد آب تبلور آن 5 است.